Карбонові кислоти. Оцтова (етанова) кислота. Функціональна карбоксильна група. Молекулярна та структурна формули оцтової кислоти, фізичні властивості. Хімічні властивості оцтової кислоти: електролітична дисоціація; взаємодія з індикаторами, металами, лугами, солями, спиртами. Застосування оцтової кислоти.
Поширення карбонових кислот в природі.
Карбонові кислоти дуже поширені у природі, побуті й промисловості. Оцтова кислота – одна з перших кислот, яка була відома людині. Уже в стародавні часи вона була виділена з оцту, який виготовляли із скислого вина. Органічними ці кислоти називають тому, що багато з них входить до складу рослинних й тваринних організмів. Кислий смак плодів й листя багатьох рослин зумовлений різними кислотами. Наприклад, в тілі мурашок, у кропиві, хвої ялини, в складі згірклого масла знаходять мурашину кислоту.
   
Валеріанова кислота міститься в коренях валеріани, щавлева – в щавлі, ревені. Оцтова кислота утворюється при оцтово-кислому бродінні, скисанні вина, соків. Вона міститься в рослинах, сечі, жовчі й шкірі тварин.
   Молочна – в молочнокислих продуктах, також утворюється при солінні та квашенні. Малонова кислота – в кормовому буряці. Аскорбінова кислота (вітамін С) – в овочах, плодах, фруктах. Молочна – в молочнокислих продуктах, також утворюється при солінні та квашенні. Малонова кислота – в кормовому буряці. Аскорбінова кислота (вітамін С) – в овочах, плодах, фруктах.
  Лимонна – в лимоні, аґрусі, гранаті, журавлині. Яблучна – в більшості плодів та овочів. Винна – у винограді. Лимонна – в лимоні, аґрусі, гранаті, журавлині. Яблучна – в більшості плодів та овочів. Винна – у винограді.
Функціональна карбоксильна група. Молекулярна та структурна формули оцтової кислоти.
Карбонові кислоти – це органічні речовини, молекули яких містять одну або кілька функціональних карбоксильних груп, сполучених з вуглеводневим радикалом або атомом Гідрогену.Функціональна група карбонових кислот - карбоксильна―COOH.
Загальна формула карбонових кислот – СnH2n+1COOH або R–COOH. Карбонові кислоти можна розглядати як похідні насичених вуглеводнів, що містять карбоксильну групу.
Карбоксильна група сполучає в собі дві функціональні групи — карбонільну (С=О) й гідроксильну (О-Н), що взаємно впливають одна на одну: 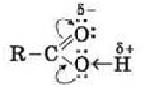
Кислотні властивості карбонових кислот зумовлені зсувом електронної густини докарбонільного Оксигену та спричиненої цим додаткової (порівняно зі спиртами) поляризації зв’язку O - H.
Оцтова кислота належить до одноосновних карбонових кислот.
Молекулярна формула оцтової кислоти – СН3СООН. 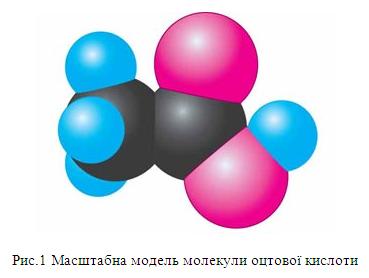
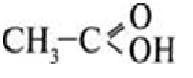 - структурна формула оцтової кислоти. - структурна формула оцтової кислоти.
Систематичні назви карбоновим кислотам даються за назвою відповідного вуглеводню з додаванням суфікса -ова і слова «кислота». Часто використовуються також тривіальні назви. Приклади карбонових кислот:
|
Формула
|
Назва
|
|
систематична
|
тривіальна
|
|
H-COOH
|
Метанова
|
Мурашина
|
|
CH3-COOH
|
Етанова
|
Оцтова
|
|
C2H5-COOH
|
Пропанова
|
Пропіонова
|
|
C3H7-COOH
|
Бутанова
|
Масляна
|
Фізичні властивості оцтової кислоти.
Оцтова кислота – це безбарвна рідина з різким характерним запахом. Безводна оцтова кислота кристалізується при температурі нижчій за +16,7°С у кристалічну масу, яка нагадує лід, внаслідок чого дістала назвульодяної оцтової кислоти. Оцтова кислота закипає при температурі +18,5°С. Вона змішується з водою при кімнатній температурі в будь-яких співвідношеннях. Її 9%-вий водний розчин відомий під назвою оцет, вживають як приправу до їжі. 70-80% оцтова кислота називається оцтовою есенцією. 
Хімічні властивості оцтової кислоти: електролітична дисоціація; взаємодія з індикаторами, металами, лугами, солями, спиртами. Застосування оцтової кислоти.
За хімічними властивостями оцтова кислота подібна до мінеральних кислот. 1. У водних розчинах вона дисоціює на йони:
CH3COOH ↔ CH3COO– + H+
За рахунок наявності катіонів Гідрогену у водному розчині оцтової кислоти спричинює зміну забарвлення індикаторів ( метиловий оранжевий, фіолетовий лакмус й універсальний індикаторний папір набувають відтінків світло – червоного кольору).
2. Взаємодія оцтової кислоти з металами:
2CH3COOH + Mg → Mg(CH3COO)2 + H2↑
магній ацетат
Ацетати – загальна назва солей оцтової кислоти.
3. Взаємодія оцтової кислоти з лугами (реакція нейтралізації):
CH3COOH + КОН →CH3COOК + H2О
4. Взаємодія оцтової кислоти з солями:
2CH3COOH + Nа2СО3→ 2CH3COONа + СО2↑+ H2О
Як представник класу карбонових кислот оцтова кислота має свої специфічні властивості.
5. Вона реагує зі спиртами з утворенням естерів:
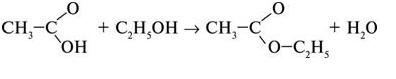
6. Вступає в реакцію галогенування, наприклад, хлорування.
У результаті реакції утворюється хлороцтова кислота і хлороводень:
CH3COOH + Cl2 → CH2ClCOOH + HCl.
Застосування оцтової кислоти.
Оцтова кислота відома з глибокої давнини як оцет, який утворюється при бродінні спиртних напоїв. Оцтова кислота серед органічних кислот використовується найбільше. Оцтову кислоту використовують:
- У харчовій промисловості як смакову й консервуючу речовину.

- Як сировина для виробництва пластмас, фруктових есенцій, лікарських препаратів (наприклад, аспірин), барвників, кіноплівки, ацетатного волокна.
- Солі оцтової кислоти застосовують як засоби для боротьби із шкідниками й хворобами рослин, стимулятори росту рослин, плюмбум ацетат (як свинцева примочка) в медицині, ферум(ІІІ) ацетат як протрава при фарбуванні тканин, що служить для закріплення барвників на волокні.
- Деякі похідні оцтової кислоти є гербіцидами.
Отримати додаткові відомості про карбонові кислоти можна: http://www.chemistry.in.ua/grade-9/chemical-properties-acetic-acid та
http://shkolyar.in.ua/spoluki/karbonovi-kisloty
Переглянути відеоматеріали:
Питання для самоконтролю:
- Які сполуки називаються карбоновими кислотами?
- Яка функціональна група входить доскладу кислот?
- Чому оцтова кислота отримала назви: етанова та льодяна?
- Що таке оцет?
- Що таке оцтова есенція?
- Які фізичні властивості оцтової кислоти?
- Які хімічні властивості характерні для оцтової кислоти?
- Наведіть загальні властивості органічних та неорганічних кислот.
- Яку особливу властивість оцтової кислоти ви знаєте?
- Назвіть галузі застосування оцтової кислоти.
Тести:
Складіть рівняння реакцій оцтової кислоти із:
а) калієм;
б) кальцієм;
в) барій оксидом;
г) натрій гідроксидом;
д) кальцій карбонатом;
е) етиловим спиртом.
Розрахуйте:
1. Масу оцтової кислоти кількістю речовини 3 моль.
2. Кількість речовини оцтової кислоти масою 180 г.
3. Яку масу оцтової кислоти необхідно, щоб приготувати 2 кг розчину з масовою часткою кислоти 9% ?
4. Молекулярну формулу речовини, що складається з С – 54,4%, О – 36,4%, Н – 9,1%. Густина за воднем цієї речовини 44.
Домашній експеримент:
1). Зміна забарвлення природніх індикаторів під впливом різних середовищ.
У три склянки налий по невеликій порції виготовленого або відвару з пелюстків квітів (можна засушених), або соку (столового буряка, червонокачанної капусти, гранату, винограду) (щось одне). У першу склянку добав трохи розчину питної соди (у розчині соди утворюється невелика кількість лугу), у другу – розчин столового оцту, а третю залиш для порівняння.
Запиши у таблицю забарвлення рослинних розчинів у кожній склянці і висновки про те, які з них є природними індикаторами.
|
Назва використаного природнього індикатора
|
Забарвлення виготовленого розчину
|
|
без сторонньої речовини
|
за наявності соди
|
за наявності столового оцту
|
|
|
|
|
|

2). Досліди дію оцтової кислоти на харчову соду.
Для цього у невелике блюдце насип гіркою (1 – 2 г) харчової соди та додай оцту. Що спостерігається?
Де використовують властивість оцтової кислоти реагувати з карбонатами?
 3). Сюрприз для мами. 3). Сюрприз для мами.
Чи помітив ти, що з часом нагрівна спіраль чи диск електричного чайника покривається осадом білого кольору? Давай позбудемось його. Для цього в чайник налий 200 г харчового оцту і залиш на ніч.
Доброго ранку! Заглянь в чайник. Що спостерігаєш? А що сказала мама?
4). Дослід «Чарівна кулька».
Налий у порожню платсикову пляшку харчового оцту (60-70г). У повітряну кульку (попередньо її надуй, а потім випусти з неї повітря) насип через лійку харчової соди. Надінь кульку на пляшку (як зображено на малюнку) та спостерігай, як кулька надувається. Чому це відбувається? Де використовують властивість оцтової кислоти реагувати з карбонатами?

|